承認・認証の一変申請

サポート行政書士法人では、医療機器製造販売承認・医療機器製造販売認証を受けられた製品の一部変更承認申請・一変についてサポートを行っています。
初めて手続きをする方、社内で対応するのが難しいという方へ弊社のリソースとノウハウで支援します。
医療機器製造販売承認・医療機器製造販売認証の一部変更承認申請・一変でお困りの方はぜひご相談ください。
承認・認証の一部変更承認申請・一変が必要となるケース
平成29年7月31日薬生機審発0731第5号「医療機器の一部変更に伴う軽微変更手続き等の取扱いについて」によると以下のようなケースは一部変更承認(一変)が必要とされています。
| ① | 製品の品質、有効性又は安全性に係る既存リスクを増大させる又は新たなリスクを生じさせる変更であって、人の生命及び健康に与える影響が明らかに軽微であるとは言えないもの |
| ② | その変更によって製品の品質、有効性及び安全性に与える影響が十分に推定できず、人の生命及び健康に与える影響が明らかに軽微であるとは言えないもの |
| ③ | 製品の形状、構造の変更であって、製品の同一性が損なわれないことが明らかでないもの(小規模な変更であって、繰り返すことにより製品の同一性が損なわれるもの、形状の著しい変化により製品の同定を困難にする変更、大幅な構造の変更により実質的に使用方法等を変化させる変更など。) |
承認・認証の一部変更承認申請・一変の範囲
どのような場合に、承認・認証の一部変更承認申請・一変が必要となるかを、厚労省はディシジョンツリーとして公表しています。
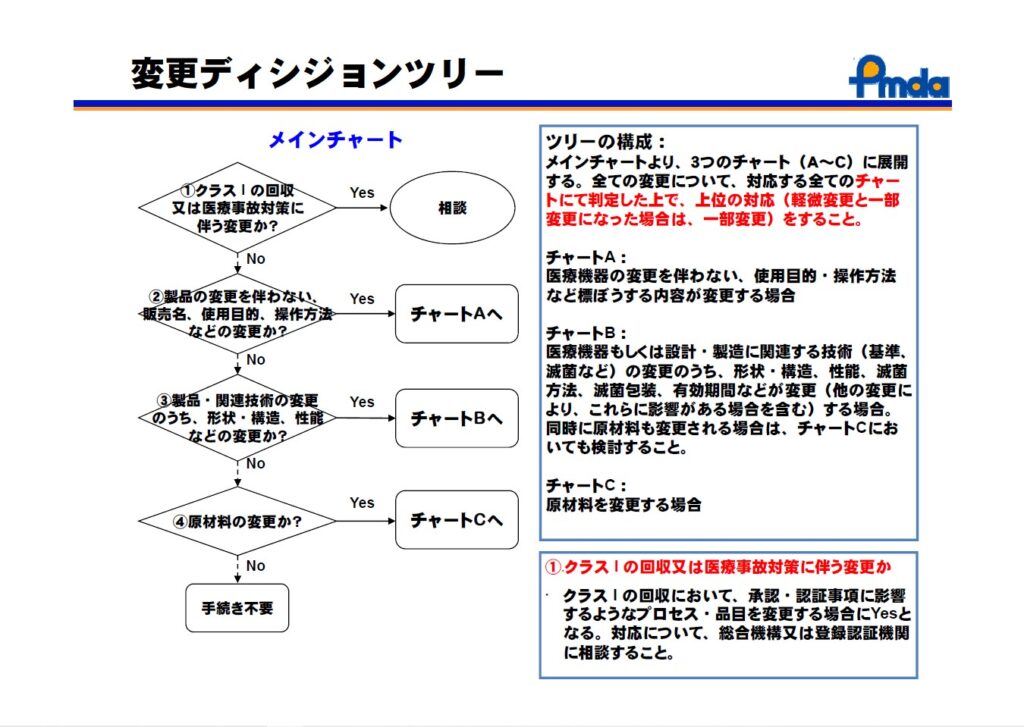
(chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.pmda.go.jp/files/000160517.pdf)
(chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.pmda.go.jp/files/000160517.pdf)
(chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.pmda.go.jp/files/000160517.pdf)
(chrome-extension://efaidnbmnnnibpcajpcglclefindmkaj/https://www.pmda.go.jp/files/000160517.pdf)
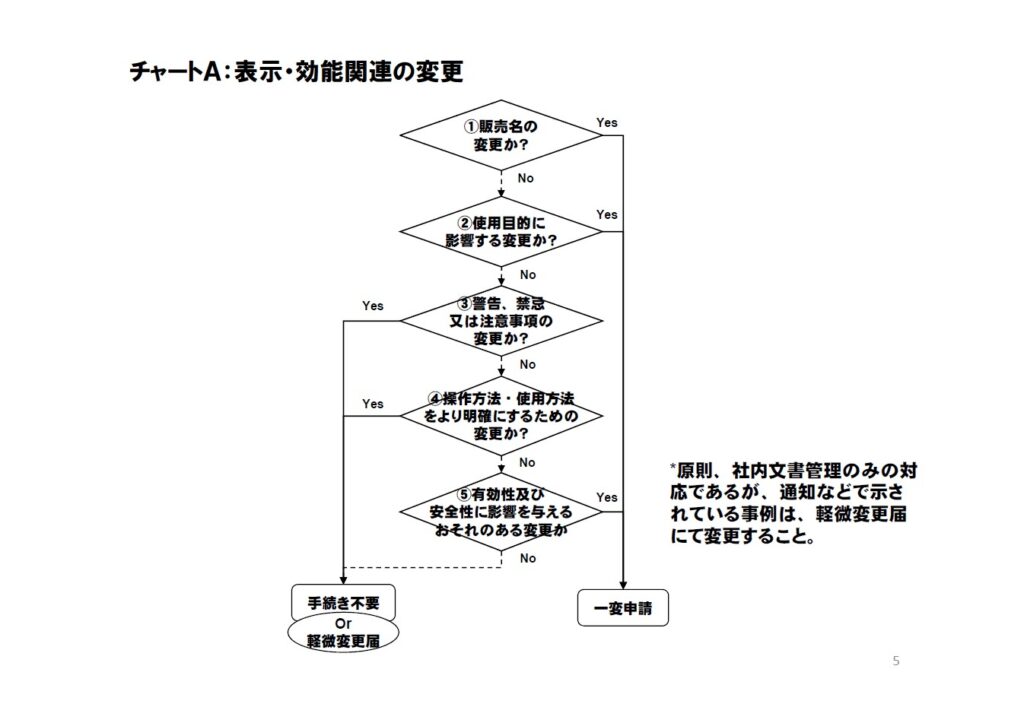
表示・効能関連の変更
| 販売名の変更か |
●販売名が変更になる場合は、一部変更承認申請 一部変更承認申請が必要。追加の場合は、別品目での申請になるため注意すること。 ●合併時の商標など、不可抗力の事由の場合は、既に通知されているとおり、軽微な変更届の対応が可能。 |
|
使用目的に影響する変更か |
●当該変更が使用目的(コンタクトレンズにおける使用区分、末梢適用から中枢適用などを含む)に影響するのか、承認事項の「使用目的、効能効果欄」への記載のみならずに検討すること。 ●例えば、コンタクトレンズにおける乱視用などの変更がここに該当する。 |
|
警告、禁忌又は注意事項の変更か |
●警告・禁忌、並びに注意事項は、通常、承認・認証事項外であるため、承認・認証上の手続きは不要であるが、PMDA安全部への相談を検討すること。 |
|
操作方法・使用方法をより明確にするための変更か |
●承認・認証申請書の「操作方法又は使用方法」欄は、基本的な操作方法を記載すればよいため、より明確に、わかりやすくするための記載の追加・変更は、「手続き不要」であるが、社内文書管理は必要となる。 ●使用方法をより明確にしたレベルを越える変更には、侵襲性が異なる使用方法への変更などがあり、この場合はNoになる。 |
|
有効性及び安全性に影響を与えるおそれのある変更か |
●有効性及び安全性に影響を与えるおそれがないのであれば えるおそれがないのであれば「手続き不要」、そのうち通知などで示されている事例などは軽微変更届出になる。 ●おそれがある場合の事例としては、使用にあたり患者への侵襲性が異なる使用方法への変更があり、これは安全性に影響がある。また、コンタクトレンズにおける連続装用の追加は、有効性・安全性に影響がある。 ●おそれがない場合の事例としては、通知に示されているとおり、承認書に組み合わせ医療機器が記載されている場合で、新たな機器の審査にて当該機器との組合せが評価されている場合における新たな機器の追加などがある。その他、承認事項外であるものの、ロゴマーク、添付文書の説明文章の変更、品名(販売名ではない呼称など)の変更なども、有効性、安全性に影響のおそれがないため、手続き不要になる。 |
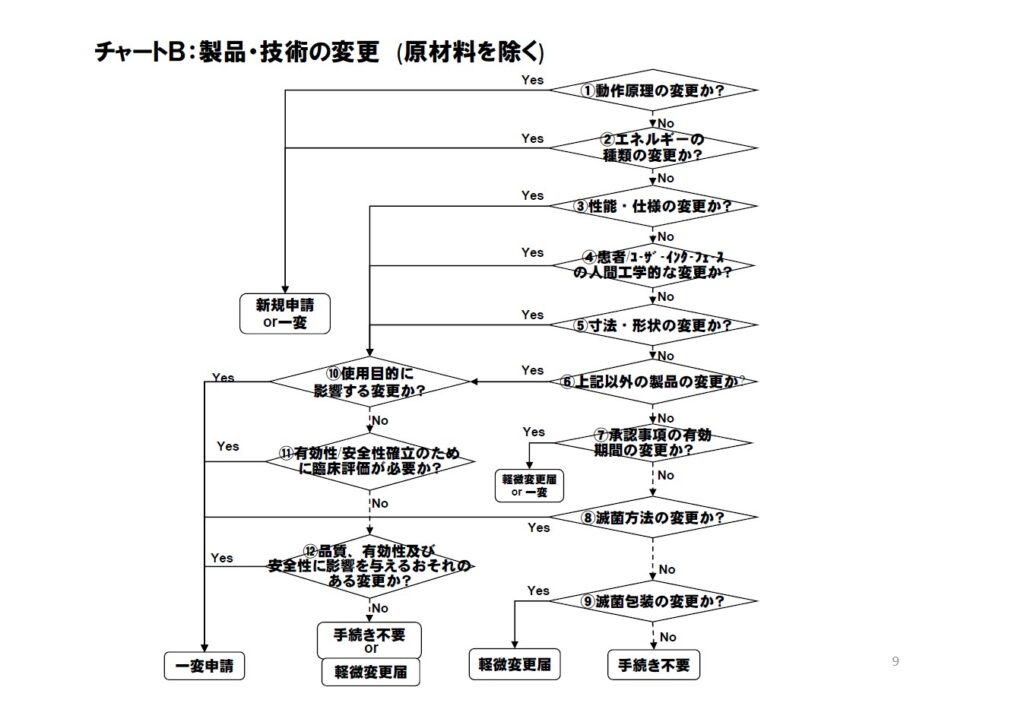
製品・技術の変更(原材料を除く)
| 動作原理の変更か |
●機器が意図された目的を達成する際の動作モードまたは動作の仕組み(原理)の変更であるか。機器の性能に大きく影響する動作原理の変更か検討する。また、電気機械制御からマイクロプロセッサ からマイクロプロセッサ制御への変更など、機器の制御機構の変更についても検討する。 ●例えば、人工心臓ポンプの機能にておける定常流か拍動流の相違、内視鏡の光源にてランプの光をファイバで導く方法から、先端で直接発光させる方式への変更、などがある。 |
|
使用目的に影響する変更か |
●当該変更が使用目的(コンタクトレンズにおける使用区分、末梢適用から中枢適用などを含む)に影響するのか、承認事項の「使用目的、効能効果欄」への記載のみならずに検討すること。 ●例えば、コンタクトレンズにおける乱視用などの変更がここに該当する。 |
|
警告、禁忌又は注意事項の変更か |
●警告・禁忌、並びに注意事項は、通常、承認・認証事項外であるため、承認・認証上の手続きは不要であるが、PMDA安全部への相談を検討すること。 |
|
エネルギーの種類の変更か |
●機器の動力源、もしくは機器から出力する動力の種類の変更。例えば、ACから内部電源への変更や、身体特性の測定における電離放射線から超音波への変更がある。 |
|
性能・仕様の変更か |
●機器が意図された目的を達成するための性能・機能、及び仕様に変更があるのか検討する。想定する機器が使用される環境の大幅な変更などについも含む。 ●例えば、医用電気機器における付帯機能の追加、人工股関節における曲げ強度、カテーテル類における引張強度、バルーンカテーテルにおけるバルーン耐圧、繰り返し拡張、透析器におけるクリアランス におけるクリアランス値、またはMRIに対する耐性を向上させる場合などが該当する。 |
|
患者/ユーザーインターフェースの人間工学的な変更か |
●機器と患者/ユーザーのインターフェース部分の変更があるか検討する。 ●例えば、危険な状態をユーザーに知らせるための各種の警告音、点滅アラーム、コントロールパネルのレイアウト、ユーザーへの情報提示方法が挙げられる。 |
|
寸法・形状の変更か |
●機器の物理的な寸法や形状が変更するのか。寸法仕様には、機器の長さ、幅、厚み、または直径、および機器のパーツや構成部品の位置が含まれる。 |
|
承認事項の有効期間の変更か |
●品目の安定性に基づく有効期間が3年を越えないとして、承認・認証事項に期間を設定している場合、その期間を延長する場合はYesとなる。軽微変更届出に該当するかは、薬食機発第0905001号(平成20年9月5日付)を参考にすること。 |
|
滅菌包装の変更か |
●薬食機発第1023001 1023001号(平成20年10月23日付)の別紙1に記載のとおり、滅菌バリデーション基準にて保証される範囲の包装材料、厚さ又は形態の変更か検討する。 |
|
使用目的に影響する変更か |
●医療機器そのものも変更が使用目的(コンタクトレンズにおける使用区分、末梢適用から中枢適用の変更などを含む)に影響するのか、承認事項の「使用目的、効能効果欄」への記載のみならずに検討すること。 |
|
有効性/安全性確立のために臨床評価が必要か |
●新しい設計の安全性と有効性を評価する際、非臨床試験データのみでは妥当性確認が不十分である場合は、少なくとも一部変更承認申請 部変更承認申請が必要である。例えば、植込み型ペースメーカにて新規性の高い治療機能を追加する場合などがYesとなる。臨床試験の要否については、必要に応じて機構に相談すること。 |
|
製品の品質、有効性及び安全性に影響を与えるおそれのある変更か |
●施行規則47条に規定されている軽微変更届出の範囲外になるのか、検討する。 ●例えば、変更に係わるリスク評価の結果、新たなリスクやリスクの増大が想定される場合は、「おそれのある変更」に該当する。 ●「影響を与えるおそれがない」には、薬食機発第1023001号(平成20年10月23日付)の別紙1にて事例が示されており、これ以外については、事前に相談すること。 ●品質、有効性及び安全性に影響を与えるおそれがない場合のうち、薬食機発第1023001号(平成20年10月23日付)の別紙2に列記されている例においては、手続き不要に該当する。 |
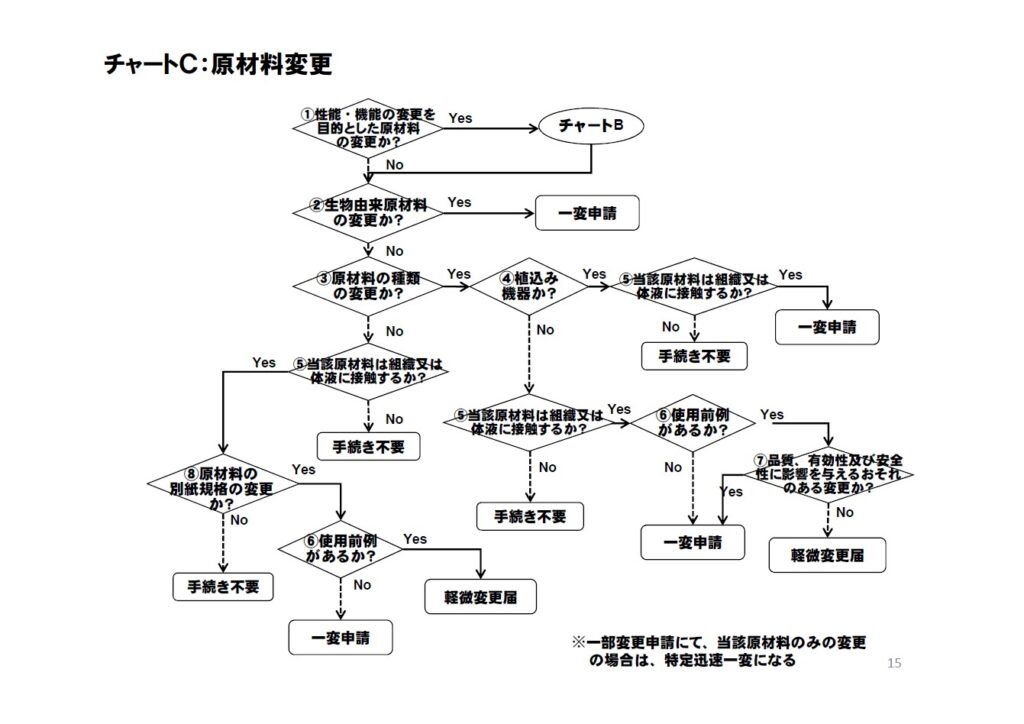
原材料変更
| 性能・機能の変更を目的とした原材料の変更か |
●原材料を変更する目的、理由を明らかにし、性能・機能の変更を目的とした原材料の変更の場合は、意図する変更内容に応じた一部変更承認申請等を行うことが必要であり、チャートBにても判断すること。 ●原材料毎に別品目扱いになる品目における原材料変更は、当該ツリーの対象外である。 |
|
生物由来原材料の変更か |
●生物由来製品として指定されているヘパリン、ウロキナーゼ、細胞組織などの原材料の変更は、一部変更承認申請が必要。ただし、通知等にて軽微変更届出などの対応が明確になっている場合を除く。 |
|
原材料の種類の変更か |
●「原材料の種類の変更」は、一般名又は通称のレベルでの変更を意味する。例えば、次頁以降の一覧表に例示された名称を用いる。 ●「原材料の種類」に変更がない場合であって、原材料供給元の変更、添加剤の変更などにあっては、承認書にて既定されている内容に応じて対応する。 ●植込み機器においては、原材料規格に相当する内容を承認書に既定すること。 |
|
植込み機器か |
●当該医療機器が植込み機器なのか、もしくは30日を超える長期的接触が想定されている医療機器なのかを判断する。 |
|
当該原材料は、組織又は体液に接触するか |
●生物学的安全性 生物学的安全性のリスクを鑑み、直接又は間接に組織又は体液に接触する部品の原材料であるのかを確認する。 ●植込み製品であっても、組織又は体液に接触しない部位に使用される原材料については、手続き不要になる。 |
|
使用前例があるか |
●変更後の原材料が既承認(認証)品に用いられている原材料で、かつ原材料の生体への接触部位、生体への接触時間が同程度又はそれ以上である原材料か否か確認する。 ●原材料の変更はなく、記載上のみの変更においては、この質問にて使用前例ありとなる。 |
|
品質、有効性及び安全性に影響を与えるおそれのある変更か |
●品質、有効性及び安全性に影響を与えるおそれのある変更であるのかを確認する。施行規則第47条に規定されているとおり、「製品の品質、有効性及び安全性に影響を与えるおそれのあるも 」については 軽微な変更に該当しない。 |
|
原材料の別紙規格の変更か |
●原材料を詳細に規定した場合にあっては、原材料の種類に変更がないものの、承認(認証)書の「原材料又は構成部品」欄に記載された原材料の別紙規格の内容を変更する必要があるかないか確認する。 |
医療機器に関する許認可のご相談はサポート行政書士法人へ
サポート行政書士法人では、新規で医療機器業界へ参入される方から、既存の製造販売業者・製造業者・販売業者の皆さまに対して、医薬品医療機器等法に関する申請サポートやコンサルティングを行っています。
医療機器の申請は専門性が高く、対応している行政書士が少ない分野の一つと言えます。
弊社の担当者は、全国の都道府県で申請実績があります。ぜひご相談ください。