品目の変更手続き
更新日:2025年10月2日
既に医療機器の承認、認証、届出を済ましている医療機器に対して何らかの変更があった場合、速やかな手続きが求められる場合があります。
この場合、恐ろしいのは、気づかず期限を超過してしまうこと、そして変更してから許可や登録の要件を満たさなくなったことが判明すること。
企業生命にかかわる大事件です。
そのような事態にならないために、正確に「変更手続きすべき変更」と「不要な変更」を把握して、適切な対応をとることが必要です。
私どもサポート行政書士法人では、医療機器の製造販売業者様及び製造業者様の変更に伴う手続きについて数多く実績があります。
もし何らかの変更をお考えなら、ご相談ください。
その変更によりどのような手続きとなるのかをご説明し、その上で「貴社のケース」での最適な対応を提案、資料収集から申請先との折衝を含めた実際の手続き代行まで、しっかりとサポートいたします。
さて、以下に製品の変更に伴う手続きの一般的な概要をお伝えしていきます。
医療機器の変更手続き流れと注意ポイント
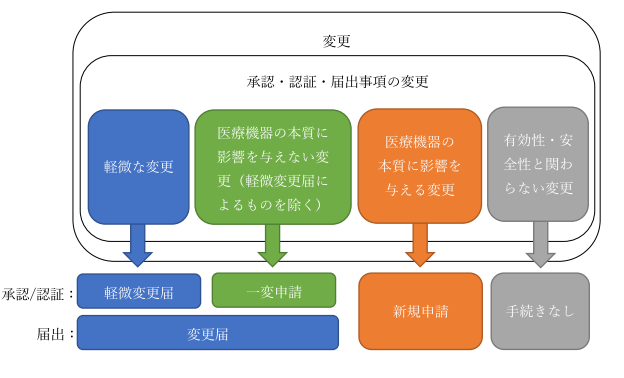
※参考:平成26年11月20日 薬食機参発1120第1号「医療機器の製造販売承認申請書の作成に際し留意すべき事項について」、平成26年11月20日 薬食機参発1120第4号「医療機器の製造販売認証申請書の作成に際し留意すべき事項について」、平成26年11月21日 薬食機参発1121第41号「医療機器の製造販売届出に際し留意すべき事項について」、平成20年10月23日薬食機発1023001号「医療機器の一部変更に伴う手続きについて」変更手続きが必要となる場合、その変更内容によって手続きの内容、留意点が大きく変わります。
手続きの種類について
手続きについては、大まかに下記のように分類がされます。
(煩雑となる為、特例的な扱いについての区分けは今回除外しています。)
実際のところ、その変更による影響を考慮して手続きを確定することになります。
そのため、実際の変更に対してどの手続きを取らなくてはならないのかを判別するのは難易度が高くなっています。
| 手続き | 考え方 | 根拠 |
| 軽微変更届(承認・認証) | 一 使用目的又は効果の追加、変更又は削除 二 病原因子の不活化又は除去方法に関する変更 三 前二号に掲げる変更のほか、製品の品質、有効性及び安全性に影響を与えるもののうち、厚生労働大臣が法第二十三条の二の五第十一項の承認を受けなければならないと認めるもの | 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律施行規則第114条の25(認証は上記を準用(第118条)) |
| 一変申請(承認・認証) | 原則として、次のような変更で、その医療機器の本質等に影響を与えない場合は承認事項一部変更承認申請による(軽微変更届によることができるものは除く) (ア)構造、原材料、性能等に係る軽度な変更 (イ)名称、形状、寸法、使用目的又は効果、性能及び安全性に関する規格等の変更 | 平成26年11月20日、薬食機参発1120第1号及び、平成26年11月20日、薬食機参発1120第4号 |
| 変更届(届) | 上述の軽微変更届及び一変申請の範囲に準じた取扱い | 平成26年11月21日 薬食機参発1121第41号 |
| 新規申請(承認・認証・届) | 原則として、次のような変更は新規承認申請による。(事例) ① 構造、原材料、性能等に係る変更のうち承認事項一部変更承認申請によるものを除くもの ② 販売名の追加 | 平成26年11月20日、薬食機参発1120第1号及び、平成26年11月20日、薬食機参発1120第4号 |
| 手続き不要(承認・認証・届) | 変更内容が総合的に判断して有効性及び安全性と直接の関連性を有さず、その医療機器の本質から見て同一性を損なうものでないとき | 平成20年10月23日薬食機発第1023001号 |
変更手続きの期限
医療機器の製造販売業者、変更時点より30日以内に、
必要資料を添えてPMDAまたは認証申請を行った登録認証機関に提出しなければなりません。
ただし、新規申請の手続きが必要となる場合には、承認又は認証申請が必要です。
さかのぼっての承認又は認証はできないからです。
計画段階から数か月の余裕をもって十分な検討を行うことをお勧めします。
サポート行政書士法人にご相談ください
前述のとおり、私どもサポート行政書士法人では、医療機器の製造販売業者様及び製造業者様の変更に伴う手続きについて数多く実績があり、専門スタッフがお客様の各種申請を迅速かつ確実に代行しています。
また、私どもは東京・名古屋・大阪の全国4箇所にオフィスを構えており、そこを起点に全国対応しています。
インターネット等を用いて海外からのご相談も承っております。
中国語・英語・韓国語対応のスタッフもおりますので、日本語では相談が難しい場合でも対応が可能です。
専門的で複雑な手続きはぜひ私どもにお任せください。
初回相談は無料です。



